11 Ene 2021
Encuentran claves para controlar la capacidad de cambios de células tumorales en cultivo
Varias empresas farmacéuticas de Estados Unidos, Inglaterra y España están probando en ensayos clínicos inhibidores de una proteína clave para la replicación de células malignas en combinación o no con los rayos y la quimioterapia. Un enfoque propuesto por el grupo que lidera Vanesa Gottifredi en la Fundación Instituto Leloir (FIL) podría superar efectos indeseables de esta estrategia, aunque se requieren más experimentos y estudios para comenzar a comprobar su eficacia.
El laboratorio de Gottifredi logró describir un mecanismo molecular que podría mejorar el desempeño de fármacos de nueva generación que se están probando en ensayos clínicos en cáncer de páncreas, ovario, próstata, mama y otros.
En esos tumores, y también en los de colon, hígado, estómago y algunas leucemias, se genera una dependencia “adictiva” de las células malignas hacia una proteína, llamada Chk1, que garantiza el copiado del ADN tumoral para la posterior multiplicación de células malignas. Por esta razón, varias empresas farmacéuticas de Estados Unidos, Inglaterra y España están probando en ensayos clínicos drogas que inhiben esa molécula en combinación (o no) con los rayos o la quimioterapia.
Pero este enfoque tampoco resuelve la frecuente reaparición de tumores después del tratamiento, un problema que hasta ahora, no ha superado ningún fármaco.
“Para comprender el modo de acción de los fármacos, sus limitaciones y para buscar estrategias superadoras, los científicos no realizamos inicialmente pruebas en pacientes y tampoco animales. Trabajamos primero con células en cultivo; intentamos matar células tumorales en una cajita de Petri. Así se empieza a buscar pistas en un laboratorio de investigación científica”, explica Gottifredi, líder del avance, jefa del Laboratorio de Ciclo Celular y Estabilidad Genómica en la FIL y ganadora del Premio Nacional L’Oréal-Unesco “Por la Mujer en la Ciencia” 2019.
Bajo la codirección de Gottifredi y Marina González Besteiro, así empezó su trabajo de tesis Nicolás Calzetta, regulando los niveles de Chk1 en células de cáncer de hueso (osteosarcoma) y de colon en cultivo. Después de 5 años, el resultado de las investigaciones fue publicado en “Science Advances”.
“La eliminación de Chk1 en células tumorales aumenta la muerte celular (resultado favorable), pero también ocasiona la acumulación de cromosomas y núcleos celulares dañados (resultado desfavorable) que pueden fomentar la reaparición de tumores postratamiento”, explica Calzetta. Y aunque se pensaba que ambas variantes eran inseparables, que no había rosas sin espinas, “encontramos una manera de provocar la muerte de las células tumorales sin inestabilidad cromosómica en el contexto de la eliminación de Chk1”, añade.
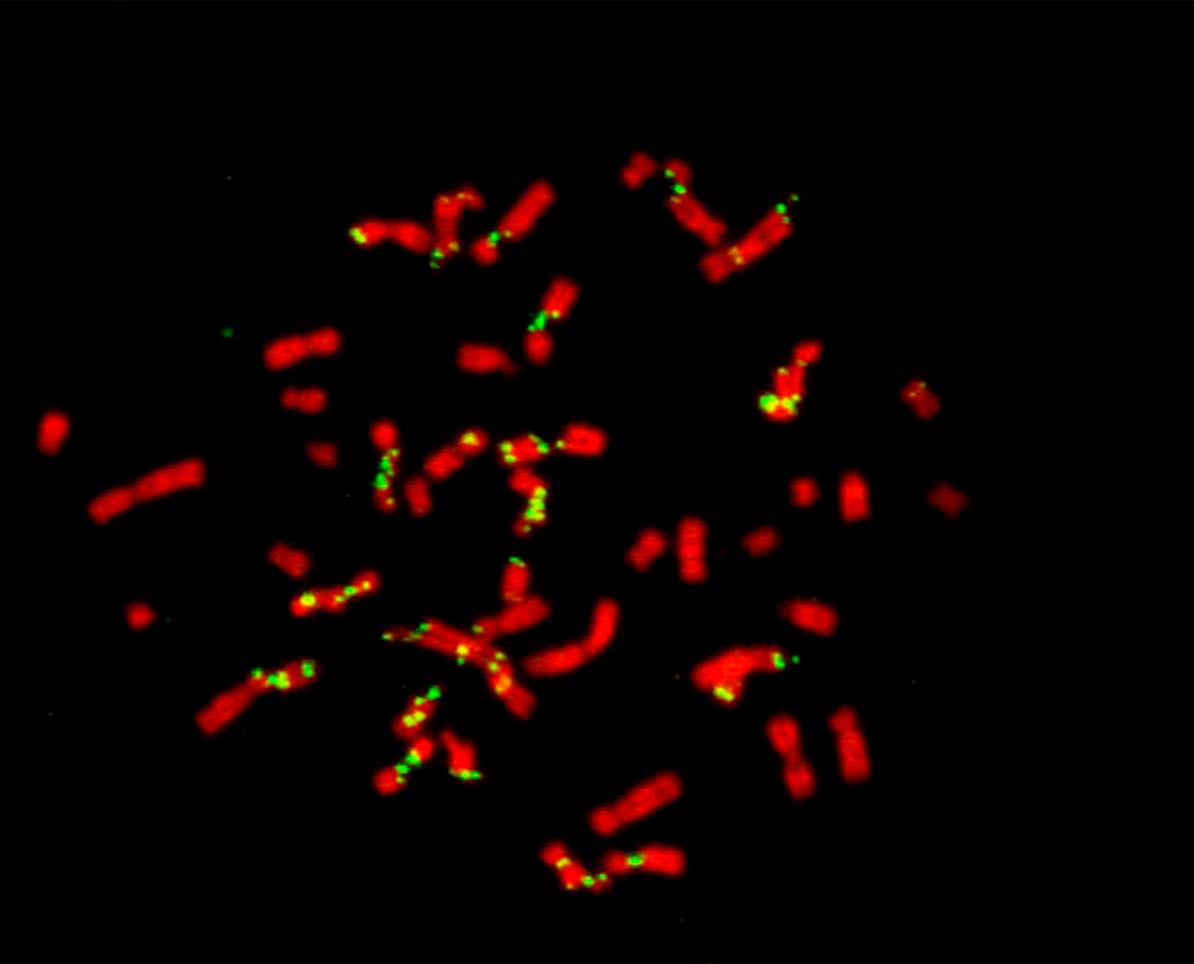 Imagen de cromosomas (rojo) y focos de síntesis de ADN (verde) en una mitosis de una célula de cáncer de colon en cultivo. Créditos: Nicolás Calzetta-Laboratorio de Ciclo Celular y Estabilidad Genómica FIL.
Imagen de cromosomas (rojo) y focos de síntesis de ADN (verde) en una mitosis de una célula de cáncer de colon en cultivo. Créditos: Nicolás Calzetta-Laboratorio de Ciclo Celular y Estabilidad Genómica FIL.
El estudio de los investigadores de la FIL encontró además a “los culpables” de esa respuesta desfavorable. Mediante análisis moleculares, comprobaron que los cambios groseros en el material genético son generados por la acción de una tijera molecular (Mus81-Eme1) sobre el ADN durante la llamada “duplicación retrasada”, que tiene lugar durante el período en el que el ADN se divide entre dos células hijas.
“Descubrimos además que, si impedimos o forzamos esa duplicación retrasada, la inestabilidad cromosómica disminuye drásticamente. Lo más interesante es que el nivel de muerte celular es siempre el mismo, lo que genera una oportunidad para revertir la inestabilidad cromosómica (asociada a la resistencia de los tumores) sin perder el efecto de la eliminación de Chk1 sobre la muerte celular”, explica González Besteiro, investigadora del CONICET en la FIL y ganadora de una mención especial del Premio Nacional L’Oréal-Unesco “Por la Mujer en la Ciencia” 2019 en la categoría Beca.
En ese sentido, los investigadores concluyeron que el proceso de síntesis de ADN retrasada es un posible blanco terapéutico para combinar con inhibidores de Chk1. “Se podrían diseñar protocolos que causen muerte tumoral, pero impidan la acumulación de inestabilidad cromosómica, mejorando de esa manera algunos esquemas terapéuticos”, indica Gottifredi, también investigadora del CONICET.
“Pero nuestro descubrimiento es tan solo una prueba de concepto inicial hecho en células en cultivo. Si bien abre una puerta a nuevas estrategias terapéuticas necesita aún recorrer un largo y riesgoso camino para ser algún día aprovechada o descartada”, aclara Gottifredi, quien también participa de un proyecto interdisciplinario, que cuenta con el apoyo del Ministerio de Ciencia y de la compañía farmacéutica GlaxoSmithKline, para desarrollar fármacos antitumorales sin efectos secundarios generados a partir de compuestos vegetales.
El laboratorio de Gottifredi logró describir un mecanismo molecular que podría mejorar el desempeño de fármacos de nueva generación que se están probando en ensayos clínicos en cáncer de páncreas, ovario, próstata, mama y otros.
En esos tumores, y también en los de colon, hígado, estómago y algunas leucemias, se genera una dependencia “adictiva” de las células malignas hacia una proteína, llamada Chk1, que garantiza el copiado del ADN tumoral para la posterior multiplicación de células malignas. Por esta razón, varias empresas farmacéuticas de Estados Unidos, Inglaterra y España están probando en ensayos clínicos drogas que inhiben esa molécula en combinación (o no) con los rayos o la quimioterapia.
Pero este enfoque tampoco resuelve la frecuente reaparición de tumores después del tratamiento, un problema que hasta ahora, no ha superado ningún fármaco.
“Para comprender el modo de acción de los fármacos, sus limitaciones y para buscar estrategias superadoras, los científicos no realizamos inicialmente pruebas en pacientes y tampoco animales. Trabajamos primero con células en cultivo; intentamos matar células tumorales en una cajita de Petri. Así se empieza a buscar pistas en un laboratorio de investigación científica”, explica Gottifredi, líder del avance, jefa del Laboratorio de Ciclo Celular y Estabilidad Genómica en la FIL y ganadora del Premio Nacional L’Oréal-Unesco “Por la Mujer en la Ciencia” 2019.
Bajo la codirección de Gottifredi y Marina González Besteiro, así empezó su trabajo de tesis Nicolás Calzetta, regulando los niveles de Chk1 en células de cáncer de hueso (osteosarcoma) y de colon en cultivo. Después de 5 años, el resultado de las investigaciones fue publicado en “Science Advances”.
“La eliminación de Chk1 en células tumorales aumenta la muerte celular (resultado favorable), pero también ocasiona la acumulación de cromosomas y núcleos celulares dañados (resultado desfavorable) que pueden fomentar la reaparición de tumores postratamiento”, explica Calzetta. Y aunque se pensaba que ambas variantes eran inseparables, que no había rosas sin espinas, “encontramos una manera de provocar la muerte de las células tumorales sin inestabilidad cromosómica en el contexto de la eliminación de Chk1”, añade.
 Imagen de cromosomas (rojo) y focos de síntesis de ADN (verde) en una mitosis de una célula de cáncer de colon en cultivo. Créditos: Nicolás Calzetta-Laboratorio de Ciclo Celular y Estabilidad Genómica FIL.
Imagen de cromosomas (rojo) y focos de síntesis de ADN (verde) en una mitosis de una célula de cáncer de colon en cultivo. Créditos: Nicolás Calzetta-Laboratorio de Ciclo Celular y Estabilidad Genómica FIL.El estudio de los investigadores de la FIL encontró además a “los culpables” de esa respuesta desfavorable. Mediante análisis moleculares, comprobaron que los cambios groseros en el material genético son generados por la acción de una tijera molecular (Mus81-Eme1) sobre el ADN durante la llamada “duplicación retrasada”, que tiene lugar durante el período en el que el ADN se divide entre dos células hijas.
“Descubrimos además que, si impedimos o forzamos esa duplicación retrasada, la inestabilidad cromosómica disminuye drásticamente. Lo más interesante es que el nivel de muerte celular es siempre el mismo, lo que genera una oportunidad para revertir la inestabilidad cromosómica (asociada a la resistencia de los tumores) sin perder el efecto de la eliminación de Chk1 sobre la muerte celular”, explica González Besteiro, investigadora del CONICET en la FIL y ganadora de una mención especial del Premio Nacional L’Oréal-Unesco “Por la Mujer en la Ciencia” 2019 en la categoría Beca.
En ese sentido, los investigadores concluyeron que el proceso de síntesis de ADN retrasada es un posible blanco terapéutico para combinar con inhibidores de Chk1. “Se podrían diseñar protocolos que causen muerte tumoral, pero impidan la acumulación de inestabilidad cromosómica, mejorando de esa manera algunos esquemas terapéuticos”, indica Gottifredi, también investigadora del CONICET.
“Pero nuestro descubrimiento es tan solo una prueba de concepto inicial hecho en células en cultivo. Si bien abre una puerta a nuevas estrategias terapéuticas necesita aún recorrer un largo y riesgoso camino para ser algún día aprovechada o descartada”, aclara Gottifredi, quien también participa de un proyecto interdisciplinario, que cuenta con el apoyo del Ministerio de Ciencia y de la compañía farmacéutica GlaxoSmithKline, para desarrollar fármacos antitumorales sin efectos secundarios generados a partir de compuestos vegetales.

