12 Nov 2019
Iluminan el origen de unas enigmáticas neuronas
Están en contacto con el líquido cefalorraquídeo, se descubrieron hace 100 años, pero su función sigue siendo un misterio. Ahora, un trabajo liderado por científicos de la Fundación Instituto Leloir (FIL) arroja luz sobre su formación durante el desarrollo embrionario.
 Guillermo Lanuza, jefe del Laboratorio de Genética del Desarrollo Neural del Instituto Leloir, e integrantes de su grupo.
Guillermo Lanuza, jefe del Laboratorio de Genética del Desarrollo Neural del Instituto Leloir, e integrantes de su grupo.
El sistema nervioso está formado por una fascinante variedad de tipos de neuronas que se producen con extraordinaria precisión durante el desarrollo. Entre ellas, están las enigmáticas “neuronas en contacto con el líquido cefalorraquídeo”, o CSF-cNs (por sus siglas en inglés), que se descubrieron hace casi un siglo, están presentes en una gran variedad de organismos, pero hasta ahora se desconocían su origen y su participación en los circuitos neuronales de la médula espinal.
Ahora, un equipo de investigadores de la FIL, con la colaboración de colegas de otros centros de investigación de Argentina y de Alemania, logró identificar cómo se forma esta clase de neuronas durante fases avanzadas del desarrollo embrionario.
“Estas neuronas son interesantes porque se encuentran en una posición anatómica de privilegio, en íntimo contacto con el líquido cefalorraquídeo, que es el fluido que llena los ventrículos cerebrales y el canal central de la médula espinal. Si bien no sabemos aún con precisión el repertorio de funciones que cumplen, esta clase neuronal posee características, propiedades y una localización estratégica que sugieren que juegan un rol clave en la ejecución de movimientos, detectando la calidad y el flujo del líquido cefalorraquídeo”, señala el director del estudio, Guillermo Lanuza, jefe del Laboratorio de Genética del Desarrollo Neural de la FIL e investigador del CONICET.
El nuevo estudio fue publicado en la revista “Cell Reports”. Lanuza, los dos primeros autores, Daniela Di Bella y Abel Carcagno, también de la FIL, y sus colegas descubrieron que la proteína Ascl1 gatilla el programa genético que produce las neuronas CSF-cNs a partir de células madre multipotentes neurales.
Realizando experimentos en ratones, un modelo animal de investigación que comparte gran parte del genoma con los humanos, los científicos demostraron que, durante el desarrollo embrionario, la proteína Ascl1 actúa como un “interruptor genético” que controla el balance entre la cantidad de neuronas CSF-cNs y los ependimocitos, unas células no-neuronales que a lo largo de la vida actúan como soporte del sistema nervioso.
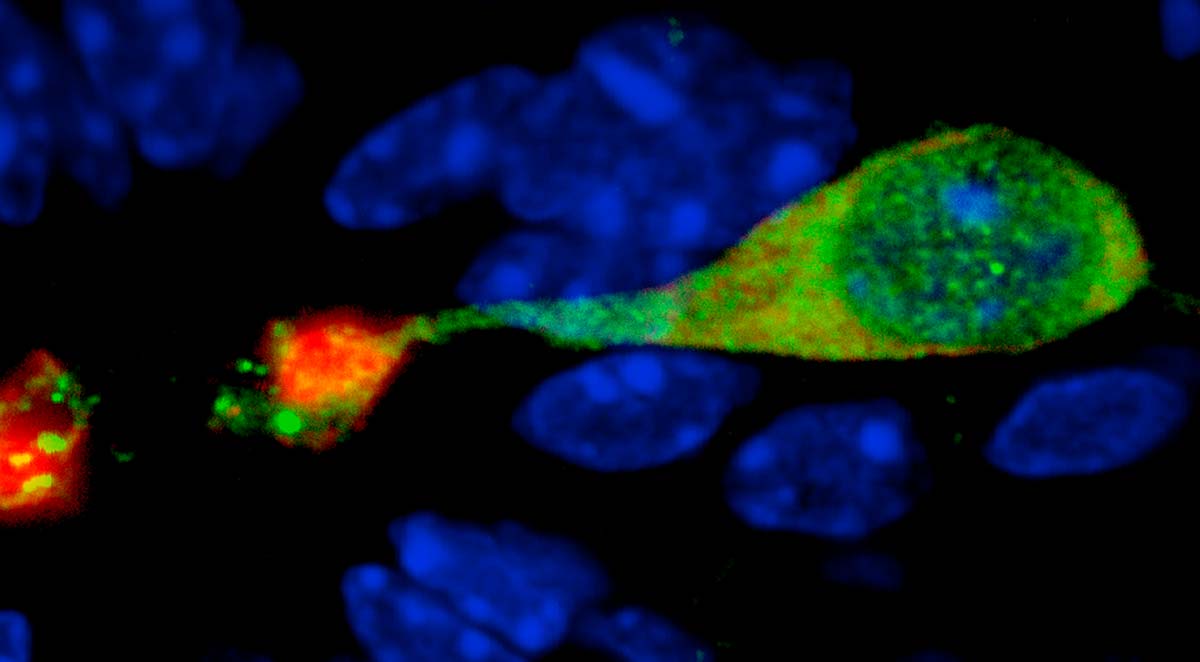 Los científicos del Instituto Leloir lograron describir cómo se forman las enigmáticas “neuronas en contacto con el líquido cefalorraquídeo” durante fases avanzadas del desarrollo embrionario
Los científicos del Instituto Leloir lograron describir cómo se forman las enigmáticas “neuronas en contacto con el líquido cefalorraquídeo” durante fases avanzadas del desarrollo embrionario
Los científicos llegaron a esos resultados empleando sofisticadas técnicas de ingeniería genética en ratones, en conjunto con microscopía de última generación y registros electrofisiológicos. Según Abel Carcagno, uno de los dos primeros autores del trabajo e integrante del laboratorio de Lanuza, “los resultados cuestionan el ‘dogma imperante’ que indicaba que en las fases más avanzadas del desarrollo se generaban exclusivamente células no-neuronales del sistema nervioso”. “Durante estas fases avanzadas, la actividad del gen Ascl1 induce la transformación de un puñado de células progenitoras en neuronas y evita que se conviertan en células no-neuronales como lo son las células gliales y ependimarias”, agrega Lanuza.
Para el doctor Marcelo Rubinstein, quien dirige el Laboratorio de Genes, Cerebro y Conducta del Instituto de Investigaciones en Ingeniería Genética y Biología Molecular (INGEBI), y no participó del estudio, las neuronas CSF-cNs “llaman la atención” por su ubicación en la primera línea de contacto con el líquido cefalorraquídeo y por su capacidad de informar al sistema nervioso acerca de la posición del eje gravitatorio “y los planos de inclinación de un animal respecto del suelo y el cielo durante la secuencia de movimientos que se dan durante un salto, una caída, el vuelo o el nado”.
El trabajo de Lanuza y su equipo “tiene una metodología impecable y aporta datos claves para entender cuándo y cómo se originan esas neuronas”, asegura Rubinstein. “Demuestra que el factor de transcripción Ascl1, además de disparar tempranamente la conversión de células progenitoras en neuronas en amplios territorios del sistema nervioso, también determina la identidad de las neuronas CSF-cNs en un momento posterior del desarrollo en donde se originan células gliales”, añade el también investigador del CONICET y profesor de la Facultad de Ciencias Exactas y Naturales de la UBA.
De acuerdo con Lanuza, la comprensión de los mecanismos moleculares básicos que controlan la diferenciación celular durante la formación del sistema nervioso “es importante para prevenir en el futuro defectos al nacimiento o diseñar estrategias de regeneración frente a lesiones de la médula espinal”.
Del avance también participaron María Lucía Bartolomeu y Nicole Siegel, de la FIL; Antonia Marin-Burgin y María Belén Pardi, del Instituto de Investigación en Biomedicina de Buenos Aires (IBioBA), dependiente del CONICET y asociado a la Sociedad Max Planck de Alemania; y Heiko Löhr y Matthias Hammerschmidt, de la Universidad de Colonia, en Alemania.
 Guillermo Lanuza, jefe del Laboratorio de Genética del Desarrollo Neural del Instituto Leloir, e integrantes de su grupo.
Guillermo Lanuza, jefe del Laboratorio de Genética del Desarrollo Neural del Instituto Leloir, e integrantes de su grupo.El sistema nervioso está formado por una fascinante variedad de tipos de neuronas que se producen con extraordinaria precisión durante el desarrollo. Entre ellas, están las enigmáticas “neuronas en contacto con el líquido cefalorraquídeo”, o CSF-cNs (por sus siglas en inglés), que se descubrieron hace casi un siglo, están presentes en una gran variedad de organismos, pero hasta ahora se desconocían su origen y su participación en los circuitos neuronales de la médula espinal.
Ahora, un equipo de investigadores de la FIL, con la colaboración de colegas de otros centros de investigación de Argentina y de Alemania, logró identificar cómo se forma esta clase de neuronas durante fases avanzadas del desarrollo embrionario.
“Estas neuronas son interesantes porque se encuentran en una posición anatómica de privilegio, en íntimo contacto con el líquido cefalorraquídeo, que es el fluido que llena los ventrículos cerebrales y el canal central de la médula espinal. Si bien no sabemos aún con precisión el repertorio de funciones que cumplen, esta clase neuronal posee características, propiedades y una localización estratégica que sugieren que juegan un rol clave en la ejecución de movimientos, detectando la calidad y el flujo del líquido cefalorraquídeo”, señala el director del estudio, Guillermo Lanuza, jefe del Laboratorio de Genética del Desarrollo Neural de la FIL e investigador del CONICET.
El nuevo estudio fue publicado en la revista “Cell Reports”. Lanuza, los dos primeros autores, Daniela Di Bella y Abel Carcagno, también de la FIL, y sus colegas descubrieron que la proteína Ascl1 gatilla el programa genético que produce las neuronas CSF-cNs a partir de células madre multipotentes neurales.
Realizando experimentos en ratones, un modelo animal de investigación que comparte gran parte del genoma con los humanos, los científicos demostraron que, durante el desarrollo embrionario, la proteína Ascl1 actúa como un “interruptor genético” que controla el balance entre la cantidad de neuronas CSF-cNs y los ependimocitos, unas células no-neuronales que a lo largo de la vida actúan como soporte del sistema nervioso.
 Los científicos del Instituto Leloir lograron describir cómo se forman las enigmáticas “neuronas en contacto con el líquido cefalorraquídeo” durante fases avanzadas del desarrollo embrionario
Los científicos del Instituto Leloir lograron describir cómo se forman las enigmáticas “neuronas en contacto con el líquido cefalorraquídeo” durante fases avanzadas del desarrollo embrionarioLos científicos llegaron a esos resultados empleando sofisticadas técnicas de ingeniería genética en ratones, en conjunto con microscopía de última generación y registros electrofisiológicos. Según Abel Carcagno, uno de los dos primeros autores del trabajo e integrante del laboratorio de Lanuza, “los resultados cuestionan el ‘dogma imperante’ que indicaba que en las fases más avanzadas del desarrollo se generaban exclusivamente células no-neuronales del sistema nervioso”. “Durante estas fases avanzadas, la actividad del gen Ascl1 induce la transformación de un puñado de células progenitoras en neuronas y evita que se conviertan en células no-neuronales como lo son las células gliales y ependimarias”, agrega Lanuza.
Para el doctor Marcelo Rubinstein, quien dirige el Laboratorio de Genes, Cerebro y Conducta del Instituto de Investigaciones en Ingeniería Genética y Biología Molecular (INGEBI), y no participó del estudio, las neuronas CSF-cNs “llaman la atención” por su ubicación en la primera línea de contacto con el líquido cefalorraquídeo y por su capacidad de informar al sistema nervioso acerca de la posición del eje gravitatorio “y los planos de inclinación de un animal respecto del suelo y el cielo durante la secuencia de movimientos que se dan durante un salto, una caída, el vuelo o el nado”.
El trabajo de Lanuza y su equipo “tiene una metodología impecable y aporta datos claves para entender cuándo y cómo se originan esas neuronas”, asegura Rubinstein. “Demuestra que el factor de transcripción Ascl1, además de disparar tempranamente la conversión de células progenitoras en neuronas en amplios territorios del sistema nervioso, también determina la identidad de las neuronas CSF-cNs en un momento posterior del desarrollo en donde se originan células gliales”, añade el también investigador del CONICET y profesor de la Facultad de Ciencias Exactas y Naturales de la UBA.
De acuerdo con Lanuza, la comprensión de los mecanismos moleculares básicos que controlan la diferenciación celular durante la formación del sistema nervioso “es importante para prevenir en el futuro defectos al nacimiento o diseñar estrategias de regeneración frente a lesiones de la médula espinal”.
Del avance también participaron María Lucía Bartolomeu y Nicole Siegel, de la FIL; Antonia Marin-Burgin y María Belén Pardi, del Instituto de Investigación en Biomedicina de Buenos Aires (IBioBA), dependiente del CONICET y asociado a la Sociedad Max Planck de Alemania; y Heiko Löhr y Matthias Hammerschmidt, de la Universidad de Colonia, en Alemania.
