14 Feb 2022
Identifican la participación de “novedosos cuerpos subcelulares” en la regulación de la fábrica de energía celular
El estudio, liderado por científicas del Instituto Leloir, se realizó en células de mamífero y sienta bases para estudiar procesos biológicos alterados que están asociados a cáncer, diabetes, obesidad y otros trastornos.
 Graciela Boccaccio (centro), directora del estudio, y Ana Julia Fernández-Álvarez (izq.) y María Gabriela Thomas, primeras autoras.
Graciela Boccaccio (centro), directora del estudio, y Ana Julia Fernández-Álvarez (izq.) y María Gabriela Thomas, primeras autoras.
Ciertas estructuras específicas que residen en el interior de las células, y que pertenecen a una nueva familia de organelas celulares llamadas “organelas sin membranas” o MLOs (por sus siglas en inglés), regulan la producción de energía celular. Su función podría explicar al menos parte del mecanismo de acción de un medicamento muy frecuentemente empleado en el tratamiento de la diabetes tipo 2, anunciaron científicas de la Fundación Instituto Leloir (FIL).
El laboratorio de Graciela Boccaccio en la FIL es uno de los pioneros en el mundo en el hallazgo de MLOs, las cuales se diferencian de las organelas celulares clásicas, como los lisosomas o las mitocondrias, que sí tienen una membrana lipídica que las envuelve.
Hace unos años, el grupo de Boccaccio descubrió que las proteínas de la familia Smaug (presente en todos los animales, incluyendo insectos y mamíferos) forman un tipo específico de MLO. Ahora, en un nuevo trabajo, basado en experimentos con líneas celulares de mamíferos, los investigadores comprobaron que las MLOs de Smaug están cargadas con ARNs mensajeros que codifican varias proteínas involucradas en la respiración mitocondrial, la cual es la fuente de la energía celular.
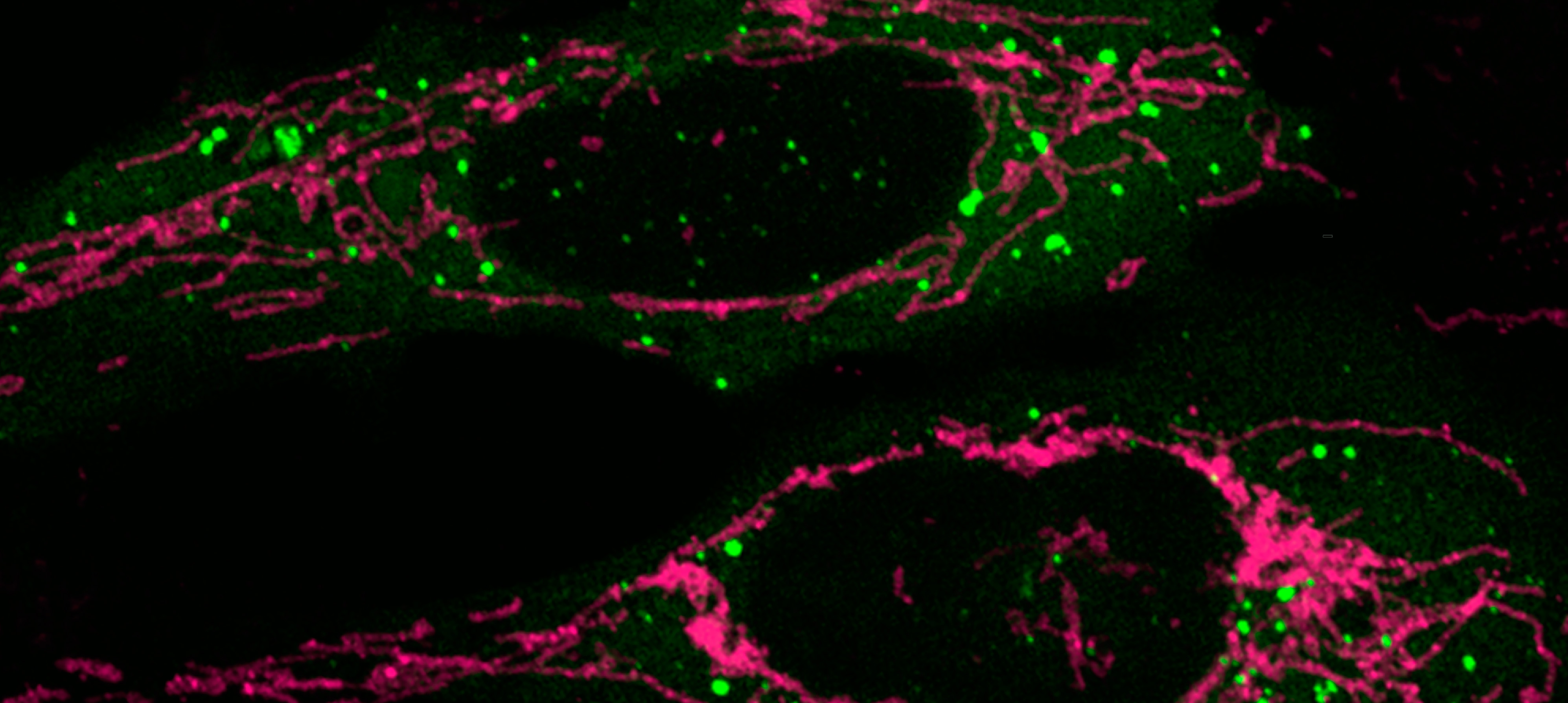 Las investigadoras descubrieron la existencia de “organelas sin membranas” o MLOs que contienen a la proteína Smaug (en verde) y estudiaron en células de mamífero in vitro su importancia en la regulación de las mitocondrias (en magenta) encargadas de producir la mayor parte de la energía celular.
Las investigadoras descubrieron la existencia de “organelas sin membranas” o MLOs que contienen a la proteína Smaug (en verde) y estudiaron en células de mamífero in vitro su importancia en la regulación de las mitocondrias (en magenta) encargadas de producir la mayor parte de la energía celular.
“La producción de energía celular depende fundamentalmente de dos ramas: la glicólisis (degradación de glucosa) y la respiración mitocondrial. Desbalances entre estas dos ramas están ligadas a cáncer, diabetes, obesidad y otros trastornos”, señala la doctora en Química Graciela Boccaccio, jefa del Laboratorio de Biología Celular del ARN de la FIL e investigadora principal del CONICET.
“Fábricas de energía celular”
El encendido y apagado y la tasa de producción de energía por parte de las mitocondrias está muy finamente controlado por la disponibilidad de nutrientes en la célula.
Los sensores principales de la disponibilidad de nutrientes y energía son “AMPK”, que se activa por falta de energía celular, y “mTOR”, que se activa en condiciones de alta disponibilidad de nutrientes.
“Dado que las MLOs de Smaug controlaban ARNs mensajeros involucrados en la respiración mitocondrial, nos preguntamos si AMPK y mTOR regulan de alguna manera la formación de las MLOs de Smaug. Y sorprendentemente, encontramos una respuesta casi inmediata: la activación de AMPK o la inhibición de mTOR dispara la rápida disolución de las MLOs de Smaug”, explica Boccaccio.
Los autores de estudio, publicado en “Journal of Cell Science” y destacado en la sección “Research Highlight” de la revista, también pudieron demostrar que la disolución de las MLOs de Smaug permite la liberación de ARNs mensajeros de enzimas mitocondriales. “De esta manera se activa su traducción y se estimula la producción de energía celular, para compensar el déficit”, indicó la científica.
En el estudio, los investigadores recurrieron a fármacos ampliamente empleados en medicina humana.
“Específicamente, estudiamos el efecto de metformina, un antidiabético de uso muy frecuente. Se sabe que este medicamente activa AMPK y nosotros encontramos que la exposición de las células a ese fármaco dispara la inmediata disolución de las MLOs de Smaug, estimulando la función mitocondrial”, puntualizó Boccaccio. Y continuó: “Esta vía de acción de la metformina no había sido descripta anteriormente y por el momento desconocemos que tan importante es en la acción terapéutica, dado que solo hemos trabajado con líneas celulares in vitro. Es una pregunta importante para seguir ahondando”.
A raíz de estos resultados, los científicos planean estudiar el rol de las MLOs de Smaug en la regulación de las mitocondrias en organismos intactos como la mosca modelo Drosophila. Un 75 % de los genes asociados con enfermedades genéticas que afectan a las personas tienen su contraparte en el genoma de este insecto.
“Se pueden lograr grandes avances antes de recurrir al uso de animales vertebrados, los cual siempre tratamos de posponer teniendo en cuenta consideraciones éticas, de costos y de velocidad de avance experimental”, concluyó Boccaccio, una de las coordinadoras del Club del ARN de Buenos Aires que cuenta con el aval de la RNA Society.
La contribución de las primeras autoras del trabajo, Ana Julia Fernández-Álvarez y María Gabriela Thomas, investigadoras adjuntas del CONICET en el grupo de Boccaccio, fue destacada en la sección “First Person” del “Journal of Cell Science”. En el estudio también participaron Malena Pascual, Pablo La Spina Y Jerónimo Pimentel, de la FIL y del CONICET; Lara Boscaglia, de la FIL; Martín Habif, Agustín Corbat y Hernán Grecco, de la Facultad de Ciencias Exactas y Naturales de la UBA; Maria Carmo-Fonseca y João Pessoa, de la Universidad de Lisboa, en Portugal; Marta Casado, del Instituto de Biomedicina de Valencia, y del Centro de Investigación Biomédica de la Red de Enfermedades Hepáticas y Digestivas (CIBERehd), en Madrid, España; y Anne Plessis, del Instituto Jacques Monod y de la Universidad Paris Diderot, en Francia.
 Graciela Boccaccio (centro), directora del estudio, y Ana Julia Fernández-Álvarez (izq.) y María Gabriela Thomas, primeras autoras.
Graciela Boccaccio (centro), directora del estudio, y Ana Julia Fernández-Álvarez (izq.) y María Gabriela Thomas, primeras autoras.Ciertas estructuras específicas que residen en el interior de las células, y que pertenecen a una nueva familia de organelas celulares llamadas “organelas sin membranas” o MLOs (por sus siglas en inglés), regulan la producción de energía celular. Su función podría explicar al menos parte del mecanismo de acción de un medicamento muy frecuentemente empleado en el tratamiento de la diabetes tipo 2, anunciaron científicas de la Fundación Instituto Leloir (FIL).
El laboratorio de Graciela Boccaccio en la FIL es uno de los pioneros en el mundo en el hallazgo de MLOs, las cuales se diferencian de las organelas celulares clásicas, como los lisosomas o las mitocondrias, que sí tienen una membrana lipídica que las envuelve.
Hace unos años, el grupo de Boccaccio descubrió que las proteínas de la familia Smaug (presente en todos los animales, incluyendo insectos y mamíferos) forman un tipo específico de MLO. Ahora, en un nuevo trabajo, basado en experimentos con líneas celulares de mamíferos, los investigadores comprobaron que las MLOs de Smaug están cargadas con ARNs mensajeros que codifican varias proteínas involucradas en la respiración mitocondrial, la cual es la fuente de la energía celular.
 Las investigadoras descubrieron la existencia de “organelas sin membranas” o MLOs que contienen a la proteína Smaug (en verde) y estudiaron en células de mamífero in vitro su importancia en la regulación de las mitocondrias (en magenta) encargadas de producir la mayor parte de la energía celular.
Las investigadoras descubrieron la existencia de “organelas sin membranas” o MLOs que contienen a la proteína Smaug (en verde) y estudiaron en células de mamífero in vitro su importancia en la regulación de las mitocondrias (en magenta) encargadas de producir la mayor parte de la energía celular.“La producción de energía celular depende fundamentalmente de dos ramas: la glicólisis (degradación de glucosa) y la respiración mitocondrial. Desbalances entre estas dos ramas están ligadas a cáncer, diabetes, obesidad y otros trastornos”, señala la doctora en Química Graciela Boccaccio, jefa del Laboratorio de Biología Celular del ARN de la FIL e investigadora principal del CONICET.
“Fábricas de energía celular”
El encendido y apagado y la tasa de producción de energía por parte de las mitocondrias está muy finamente controlado por la disponibilidad de nutrientes en la célula.
Los sensores principales de la disponibilidad de nutrientes y energía son “AMPK”, que se activa por falta de energía celular, y “mTOR”, que se activa en condiciones de alta disponibilidad de nutrientes.
“Dado que las MLOs de Smaug controlaban ARNs mensajeros involucrados en la respiración mitocondrial, nos preguntamos si AMPK y mTOR regulan de alguna manera la formación de las MLOs de Smaug. Y sorprendentemente, encontramos una respuesta casi inmediata: la activación de AMPK o la inhibición de mTOR dispara la rápida disolución de las MLOs de Smaug”, explica Boccaccio.
Los autores de estudio, publicado en “Journal of Cell Science” y destacado en la sección “Research Highlight” de la revista, también pudieron demostrar que la disolución de las MLOs de Smaug permite la liberación de ARNs mensajeros de enzimas mitocondriales. “De esta manera se activa su traducción y se estimula la producción de energía celular, para compensar el déficit”, indicó la científica.
En el estudio, los investigadores recurrieron a fármacos ampliamente empleados en medicina humana.
“Específicamente, estudiamos el efecto de metformina, un antidiabético de uso muy frecuente. Se sabe que este medicamente activa AMPK y nosotros encontramos que la exposición de las células a ese fármaco dispara la inmediata disolución de las MLOs de Smaug, estimulando la función mitocondrial”, puntualizó Boccaccio. Y continuó: “Esta vía de acción de la metformina no había sido descripta anteriormente y por el momento desconocemos que tan importante es en la acción terapéutica, dado que solo hemos trabajado con líneas celulares in vitro. Es una pregunta importante para seguir ahondando”.
A raíz de estos resultados, los científicos planean estudiar el rol de las MLOs de Smaug en la regulación de las mitocondrias en organismos intactos como la mosca modelo Drosophila. Un 75 % de los genes asociados con enfermedades genéticas que afectan a las personas tienen su contraparte en el genoma de este insecto.
“Se pueden lograr grandes avances antes de recurrir al uso de animales vertebrados, los cual siempre tratamos de posponer teniendo en cuenta consideraciones éticas, de costos y de velocidad de avance experimental”, concluyó Boccaccio, una de las coordinadoras del Club del ARN de Buenos Aires que cuenta con el aval de la RNA Society.
La contribución de las primeras autoras del trabajo, Ana Julia Fernández-Álvarez y María Gabriela Thomas, investigadoras adjuntas del CONICET en el grupo de Boccaccio, fue destacada en la sección “First Person” del “Journal of Cell Science”. En el estudio también participaron Malena Pascual, Pablo La Spina Y Jerónimo Pimentel, de la FIL y del CONICET; Lara Boscaglia, de la FIL; Martín Habif, Agustín Corbat y Hernán Grecco, de la Facultad de Ciencias Exactas y Naturales de la UBA; Maria Carmo-Fonseca y João Pessoa, de la Universidad de Lisboa, en Portugal; Marta Casado, del Instituto de Biomedicina de Valencia, y del Centro de Investigación Biomédica de la Red de Enfermedades Hepáticas y Digestivas (CIBERehd), en Madrid, España; y Anne Plessis, del Instituto Jacques Monod y de la Universidad Paris Diderot, en Francia.
